西维来司他钠治疗肺动脉高压的潜力: 基于网络药理学的靶点识别和机制探索
2025年5月,四川攀枝花市中心医院重症医学科邓小东教授团队于《Drug Des Devel Ther》(一区,IF=4.7)上发布了文章《Potential of Sivelestat for Pulmonary Arterial Hypertension Treatment: Network Pharmacology-Based Target Identification and Mechanistic Exploration》。该研究发现: ①西维来司他钠具有通过不同靶点和途径治疗肺动脉高压(PAH)的潜力。 ②体内实验表明,以100mg/kg的剂量使用西维来司他钠可显著减轻 PAH 并改善肺血管重塑。 ③体外实验表明,西维来司他钠能有效减少缺氧诱导的肺动脉内皮细胞(PAECs)和平滑肌细胞(PASMCs)的增殖和迁移。
目的:西维来司他钠是一种特异性中性粒细胞弹性蛋白酶抑制剂,目前已被批准用于治疗急性肺损伤和急性呼吸窘迫综合征。鉴于西维来司他钠已确定的抗炎和抗氧化特性,其治疗肺动脉高压(PAH)的疗效仍不确定。本研究旨在探讨西维来司他钠治疗 PAH 的潜力。 方法:使用缺氧诱导的大鼠模型(10%氧气,4周)和肺动脉内皮/平滑肌细胞(1%氧气)评估西维来司他钠对PAH的影响。大鼠接受西维来司他钠(20-100 mg/kg)治疗 2 周,并进行血液动力学(RVSP)和血管重塑(%WT)评估。在体外,西维来司他钠(50-200 μM)抑制了缺氧驱动的增殖(CCK-8、EdU)、迁移(Transwell)和血管生成。通过 qPCR/Western 印迹进行的分子验证证实了关键靶点(IGF1R、JAK1、JAK2、PDGFRB)表达的减少。 结果:通过预测分析,我们确定了 595 个与西维来司他钠治疗 PAH 相关的潜在基因。值得注意的是,ERBB2、IGF1R、JAK1、JAK2、PDGFRB 和 PTPN11 成为关键的枢纽基因。体内实验表明,以100mg/kg的剂量使用西维来司他钠可显著减轻 PAH 并改善肺血管重塑。体外实验表明,西维来司他钠能有效减少缺氧诱导的 PAECs 和 PASMCs 的增殖和迁移。 结论:西维来司他钠具有通过不同靶点和途径治疗 PAH 的潜力。我们初步阐明了西维来司他钠治疗 PAH 的分子机制,并通过分子对接研究和实验方法进行了初步验证。
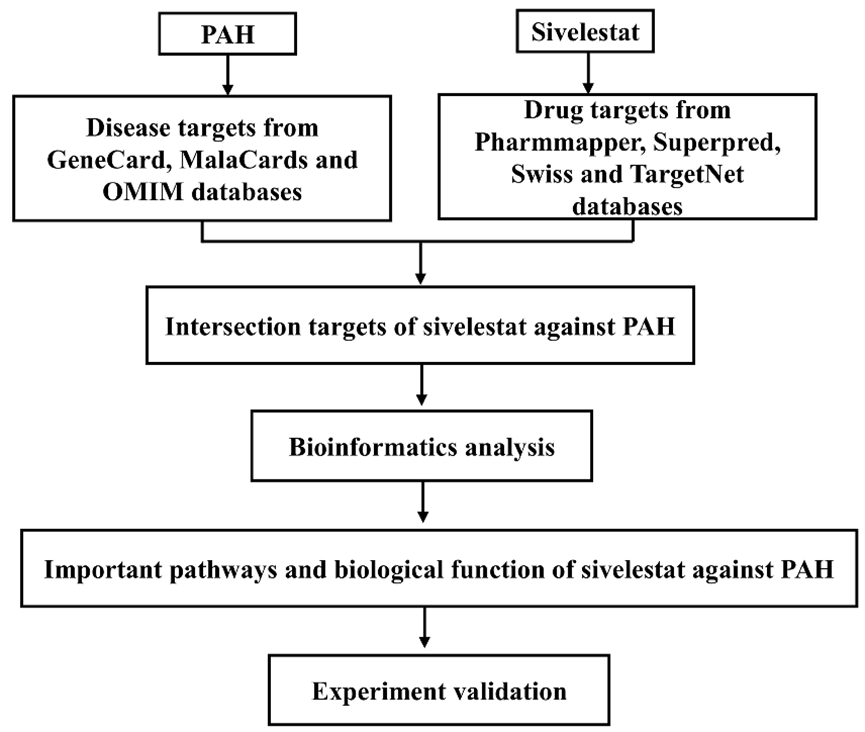
据流行病学研究估计,PAH 的发病率约为每百万人口 15-50 例,发病率因潜在病因(如特发性 PAH、结缔组织疾病和左心疾病)而异。PAH 的发病机制是多因素的,涉及复杂的分子调控网络,包括血管重塑、炎症和内皮功能障碍。目前的治疗方案包括血管扩张剂、内皮素受体拮抗剂和磷酸二酯酶-5抑制剂;然而,许多患者仍无症状,这凸显了对新治疗策略的需求。鉴于 PAH 所涉及的分子通路错综复杂,因此迫切需要针对这些机制的新型药物,以最终改善患者的预后和生活质量。 新的证据表明,中性粒细胞弹性蛋白酶(NE)与 PAH 的进展有关,它通过降解细胞外基质成分、激活促炎细胞因子和诱导内皮功能障碍来促进血管重塑。作为一种特异性 NE 抑制剂,西维来司他钠已在急性肺损伤和脓毒症临床前模型中显示出减少血管损伤和炎症反应的疗效,关键的是,最近的研究强调了 NE 在推动肺动脉平滑肌细胞 (PASMC) 增殖和内皮细胞凋亡中的作用,这些过程是 PAH 发病机制的核心。通过抑制 NE,西维来司他钠可能会破坏这些通路,从而为改善 PAH 提供一种新的机制。现有的 PAH 疗法(如血管扩张剂、内皮素拮抗剂)主要针对血流动力学异常,但不足以解决血管重塑问题。西维来司他钠的双重作用--抑制炎症和直接抑制血管细胞增殖--使其有望成为填补这一治疗空白的候选药物。网络药理学是一种整合了系统生物学和药理学的新方法,使研究人员能够探索药物、靶点和疾病之间的相互作用。网络药理学于 2000 年代初引入,强调了生物系统的复杂性和疾病的多因素性质。本研究旨在利用网络药理学阐明西维来司他钠治疗 PAH 的潜在靶点和生物机制,从而深入了解其对这种复杂疾病的治疗意义。研究流程图如下(图 1)。
图 1 网络药理学研究流程图
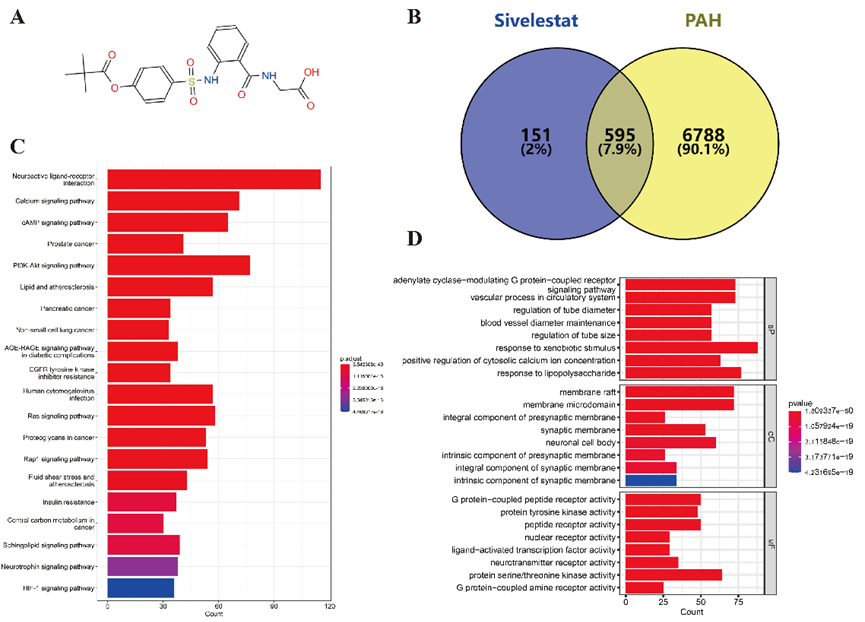
1 .西维来司他钠和 PAH 靶标的鉴定 西维来司他钠和 PAH 靶标的鉴定。我们利用 ZINC 数据库研究了西维来司他钠的二维结构(图 2A)。随后,我们在PharmMapper、SuperPred、Swiss和TargetNet数据库中进行了搜索,删除了重复的数据库,最终确定了746个基因作为西维来司他钠的潜在靶点。为了收集与 PAH 相关的致病基因,我们利用了 GeneCard、MalaCards 和 OMIM 数据库。在剔除重复基因后,7383 个基因被确定为候选致病基因。通过将这些基因与之前确定的西维来司他钠的潜在靶点交叉,我们得到了西维来司他钠治疗 PAH 的 595 个潜在靶点(图 2B)。随后,我们利用OmicShare在线平台对这595个基因进行了GO富集分析和KEGG信号通路分析,以阐明西维来司他钠治疗PAH的可能机制。通过直方图显示了按q值排名的前20条KEGG信号通路以及前8条BP、CC和MF术语。图中展示了对前十条 KEGG 信号通路的分析,这些通路包括 神经活性配体-受体相互作用、钙信号通路、cAMP 信号通路、前列腺癌、PI3K-Akt 信号通路、脂质与动脉粥样硬化、胰腺癌、非小细胞肺癌、糖尿病并发症中的 AGE-RAGE 信号通路以及表皮生长因子受体酪氨酸激酶抑制剂耐药性(图 2C)。前八个 BP 术语包括腺苷酸环化酶调节 G 蛋白偶联受体信号通路、循环系统内的血管过程、管径调节、血管直径维持、管径调节、对异种生物刺激的反应、细胞膜钙离子浓度的正向调节以及对脂多糖的反应。相关的 CC 术语包括膜筏、膜微域、突触前膜的完整成分、突触膜、神经元细胞体、突触前膜的固有成分、突触膜的完整成分和突触膜的固有成分。相关的 MF 术语包括 G 蛋白偶联肽受体活性、蛋白酪氨酸激酶活性、肽受体活性、核受体活性、配体激活的转录因子活性、神经递质受体活性、蛋白丝氨酸/苏氨酸激酶活性、G 蛋白偶联胺受体活性(图 2D)。
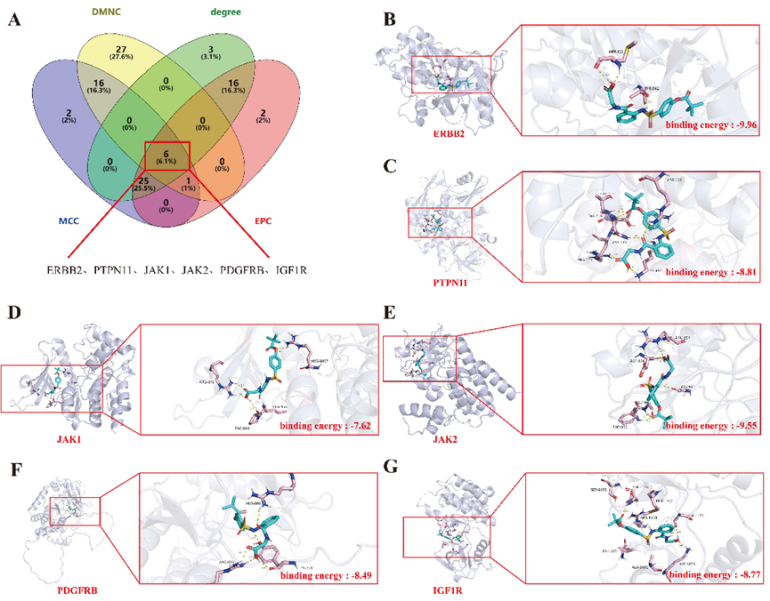
图 2 西维来司他钠治疗 PAH 的潜在生物靶点、功能过程和信号通路。(A) 西维来司他钠的化学结构。(B) 通过维恩图确定西维来司他钠治疗 PAH 的 595 个潜在靶点。(C) KEGG 富集分析得出的前 20 个信号通路。(D) 通过 GO 富集分析得出的前 20 个生物过程 (BP)、细胞成分 (CC) 和分子功能 (MF)。 2 .通过分子对接研究确认西维来司他钠与枢纽基因的结合亲和力 为了确定与西维来司他钠治疗 PAH 相关的枢纽基因,我们采用了四种算法: 度、MCC、EPC 和 CMNC,从而确定了前 50 个靶点。其中,我们发现了六个重叠靶点: ERBB2、PTPN2、JAK1、JAK2、PDGFRB 和 IGF1R(图 3A)。这六个枢纽基因很可能在西维来司他钠对 PAH 的治疗效果中发挥重要作用。我们从 PDB 数据库中检索到了这些枢纽基因的三维晶体结构。随后,我们利用Autodock Vina软件进行了核心化合物与靶基因之间的分子对接,并利用Pymol软件对对接结果进行了可视化并计算了结合能。对接结果表明,自由结合能超过-6.5 kcal/mol,表明结合作用稳定。具体来说,ERBB2与西维来司他钠的结合能为-9.96 kcal/mol(图3B),其次是PTPN2为-8.81 kcal/mol(图3C),JAK1为-7.62 kcal/mol(图3D),JAK2为-9.55 kcal/mol(图3E),PDGFRB为-8.49 kcal/mol(图3F),IGF1R为-8.77 kcal/mol(图3G)。
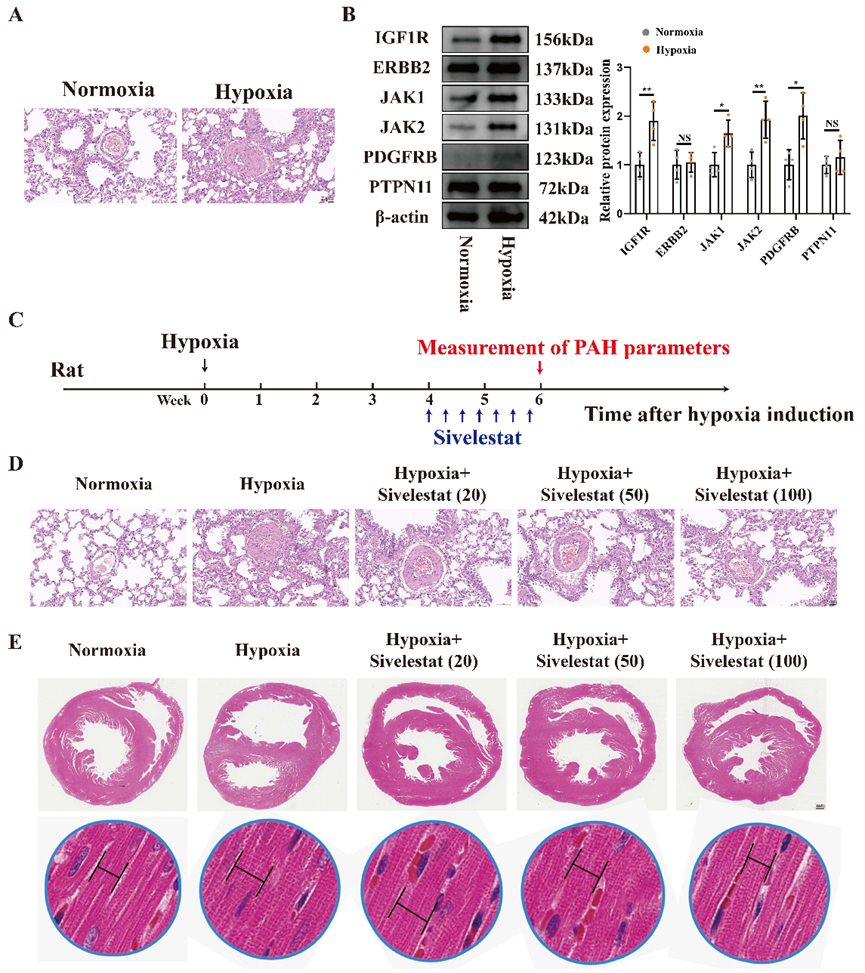
图 3 利用网络药理学方法鉴定西维来司他钠治疗 PAH 的潜在靶点。(A)收集由 Degree、MCC、EPC 和 DMNC 算法产生的前 50 个基因,并将重叠的靶点识别为中心基因。(B-G)利用分子对接来证明西维来司他钠与枢纽基因的结合,并计算相应的结合能。 3 .西维来司他钠能缓解缺氧诱导的 PAH 的血管重塑和右心室肥大 为了研究西维来司他钠是否能通过影响六个枢纽基因来缓解 PAH,我们建立了一个低氧诱导的 PAH 模型(图 4A)。目前的研究表明,西维来司他钠具有抗炎和保护血管内皮的特性。结果表明,ERBB2 和 PTPN11 在 PAECs 中的表达水平相对保持不变,而 IGF1R、JAK1、JAK2 和 PDGFRB 的表达则显著增加(图 4B)。我们认为,造成这种现象的根本原因是,ERBB2 和 PTPN11 在 PAH 的进展过程中并不在 PAECs 中发挥关键作用;相反,它们在 PASMCs 或其他细胞类型中可能更具相关性。因此,西维来司他钠介导的内皮保护作用可能主要是通过 IGF1R、JAK1、JAK2 和 PDGFRB 促进的。为了评估我们的假设,我们设计了以下动物实验方案(图 4C)。结果表明,与常氧组相比,缺氧组的血管直径增大,管腔变窄。在 100 mg/kg的剂量下,西维来司他钠能显著缓解血管直径和管腔狭窄的变化(图 4D)。同样,与正常缺氧组相比,缺氧组右心室的心肌细胞明显增大和肥厚。值得注意的是,随着西维来司他钠浓度的增加,右心室肥大有明显改善,心肌细胞肥大减少(图 4E)。
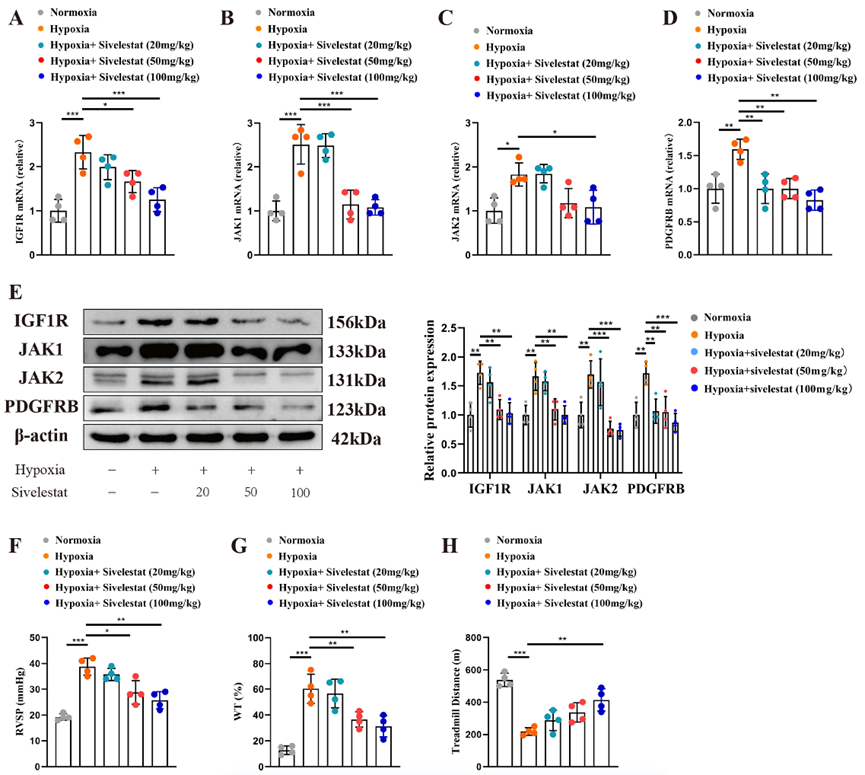
图 4 西维来司他钠能缓解肺血管重塑和右心室肥大。(A) 缺氧和常氧条件下肺血管的代表性图像。条形图:20 微米。(B) 缺氧和常氧条件下大鼠 PAECs 中各种蛋白质的表达水平。(C) 动物实验流程图。(D) 不同处理条件下肺血管的代表性图像。条形图:20 μm。(E) 不同处理条件下的心脏切片。条距:1 毫米。*P < 0.05, **P < 0.01, ***P < 0.001, ns: 无显著性。 4 .西维来司他钠可通过调节 IGF1R、JAK1、JAK2 和 PDFRB 的表达缓解 PAH 为了阐明西维来司他钠缓解肺血管重塑的具体机制,我们分离了各组大鼠的肺血管,刮除血管内膜,并评估了IGF1R、JAK1、JAK2和PDFRB的mRNA和蛋白表达水平。结果表明,与常氧条件相比,缺氧会显著增加 PAECs 中 IGF1R、JAK1、JAK2 和 PDFRB 的 mRNA 表达。相比之下,西维来司他钠能明显降低这些标记物的表达水平(图 5A-D)。在蛋白质水平上也观察到了一致的结果(图 5E)。为了准确评估 PAH 的缓解程度,我们测量了 RVSP。值得注意的是,西维来司他钠连续两周的治疗显著降低了缺氧引起的RVSP升高(图5F)。我们采用 WT% 来评估血管重塑,同样,西维来司他钠也改善了血管重塑的结果(图 5G)。除了形态学变化,我们还研究了生理变化。我们对大鼠运动能力的测试表明,缺氧组大鼠的运动能力显著下降;然而,西维来司他钠治疗后,大鼠的运动能力明显提高(图 5H)
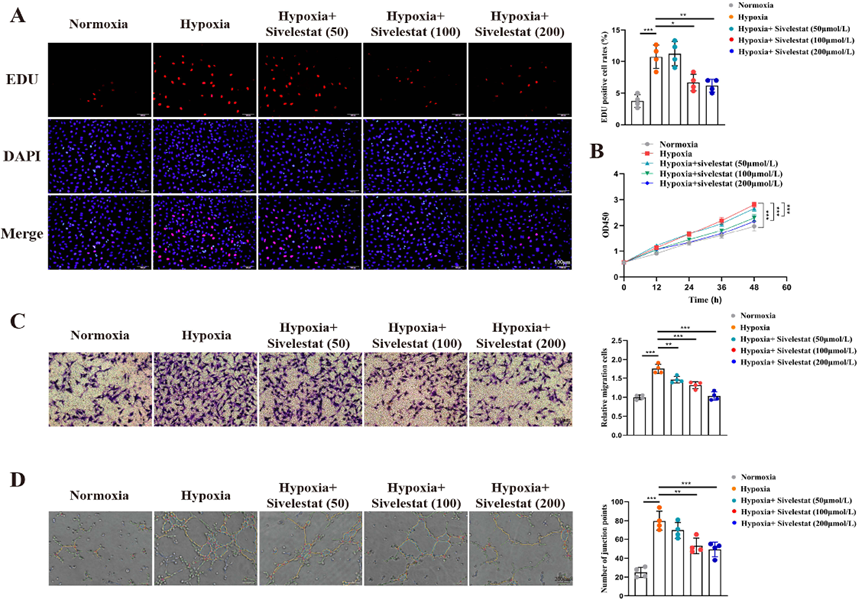
图 5 西维来司他钠缓解 PAH 的过程。(A-D)不同治疗条件下大鼠肺血管内皮细胞中 IGF1R、JAK1、JAK2 和 PDGFRB 的 mRNA 表达水平。(E)不同治疗条件下大鼠肺血管内皮细胞中 IGF1R、JAK1、JAK2 和 PDGFRB 的蛋白表达水平。(F) 不同处理条件下大鼠的右心室压力。(G)不同治疗条件下大鼠血管壁厚度比。(H)不同治疗条件下大鼠的运动能力。*P < 0.05,**P < 0.01,***P < 0.001。 5 .西维来司他钠可减少缺氧诱导的 PAECs 增殖、迁移和血管生成 PAECs 的过度增殖、迁移和血管生成紊乱是 PAH 发病的重要原因。为了进一步阐明西维来司他钠改善血管重塑的机制,我们研究了西维来司他钠治疗后 PAECs 的表型变化。我们采用 EDU 和 CCK8 检测法评估 PAECs 的增殖能力。EDU 结果表明,缺氧环境促进了 PAEC 的增殖,而西维来司他钠则减轻了缺氧的增殖效应(图 6A)。CCK8 试验也证实了这一发现(图 6B)。此外,我们还利用 Transwell 试验来评估 PAECs 的迁移能力。结果表明,缺氧增强了 PAEC 的迁移能力,而西维来司他钠处理则减少了缺氧诱导的迁移(图 6C)。鉴于西维来司他钠的作用靶点与血管形成密切相关(图 3D),我们通过以血管形成为重点的实验对此进行了进一步评估。结果发现,缺氧刺激 PAEC 血管形成,而西维来司他钠能显著抑制缺氧诱导的血管形成(图 6D)。为了阐明 IGF1R、JAK1、JAK2 和 PDGFRB 在介导西维来司他钠作用中的关键作用,我们过表达了这些靶标(图 S1)。我们观察到,过表达 IGF1R、JAK1、JAK2 或 PDGFRB 可以逆转西维来司他钠对细胞增殖和迁移的抑制作用。值得注意的是,JAK2过表达后对西维来司他钠活性的抑制最为明显(图 S2)。
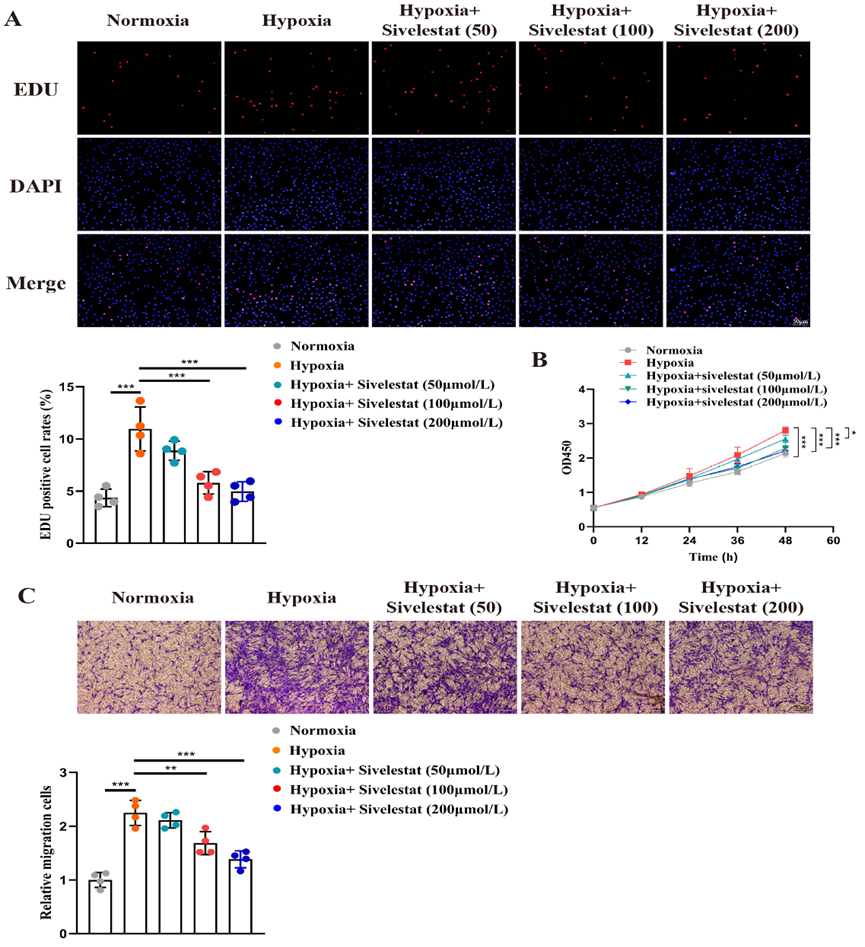
图 6 西维来司他钠可减轻缺氧诱导的 PAECs 增殖、迁移和血管生成。(图 6 西维司他抑制缺氧诱导的 PAECs 增殖、迁移和血管生成。条形图:100 微米。(B)在不同时间点进行 CCK8 检测,测量不同处理条件下的细胞数量,并绘制细胞增殖曲线。(C)采用 Transwell 试验评估不同处理条件下的细胞迁移能力,细胞数量越多,迁移能力越强。条形图:100 微米。(D) 采用管形成试验评估不同组间的血管生成能力,结果用 ImageJ 软件分析。条形图:200 μm。*p < 0.05,**p < 0.01,***p < 0.001。 6 .西维来司他钠可减少缺氧诱导的 PASMCs 增殖和迁移 我们的观察表明,肺血管重塑的组织学形态显示,PASMCs 的增殖和迁移是导致管腔狭窄和管壁增厚的主要因素。因此,我们进一步研究了西维来司他钠对这些细胞的影响。EDU 实验结果表明,缺氧会显著增强 PASMCs 的增殖;然而,施用西维来司他钠会减轻这种缺氧对细胞增殖的影响(图 7A)。CCK8 实验也得出了类似的结论(图 7B)。此外,我们还使用 Transwell 试验评估了 PASMC 的迁移能力。结果表明,缺氧促进了这些细胞的迁移,而西维来司他钠的施用则有效抵消了这种促进作用(图 7C)。此外,过表达 IGF1R、JAK1、JAK2 或 PDGFRB 可逆转西维来司他钠对 PASMC 增殖和迁移的抑制作用,其中过表达 JAK2 的挽救效果最明显(图 S3)。
图 7 西维来司他钠可减少缺氧诱导的肺动脉平滑肌细胞增殖和迁移。(A)用 EdU 检测法评估不同处理条件下 PASMC 的增殖能力,红色表示增殖细胞,蓝色表示细胞核。条形图:50 微米。(B)在不同时间点进行 CCK8 检测,测量不同处理条件下的细胞数量,并绘制细胞增殖曲线。(C)采用 Transwell 试验评估不同处理条件下的细胞迁移能力,细胞数量越多,迁移能力越强。条形图:50 μm。*p < 0.05,**p < 0.01,***p < 0.001
均方根偏差(RMSD)是评估蛋白质配体复合物构象稳定性的可靠指标,可量化原子坐标与其初始构型的位置偏差。RMSD 值越低,说明构象稳定性越好。因此,RMSD分析被用来评估模拟系统的平衡状态。JAK1-Sivelestat 复合物在 60 毫微秒后达到平衡,RMSD 波动稳定在 3.0 Å 左右;IGF1R-Sivelestat 复合物在 20 毫微秒内达到平衡(RMSD ~3.4 Å),而 PDGFRB-Sivelestat 系统在 80 毫微秒后达到平衡(RMSD ~9.4 Å)。值得注意的是,JAK2-JH1-西维来司他钠复合物在 10 毫微秒内迅速稳定(RMSD ~2.9 Å)(图 S4A)。这些结果共同表明,西维来司他钠与靶蛋白(JAK1、IGF1R、PDGFRB 和 JAK2)之间的结合稳定性很强。 进一步的结构分析表明,在分子动力学模拟过程中,所有复合物的回旋半径(Rg)和可溶解表面积(SASA)值都有轻微波动(图 S4B-S4C),这表明在配体与蛋白质相互作用过程中存在构象调整,同时保持了整体结构的完整性。 氢键在介导配体-蛋白质相互作用和稳定分子识别方面起着关键作用。在整个分子动力学模拟过程中,我们系统地分析了西维来司他钠与各种蛋白质靶标之间的动态氢键数(图 S4D)。 JAK1 - 西维来司他钠复合物的氢键波动范围为 0 到 6,在整个模拟轨迹中主要占据约 4 个氢键。同样,IGF1R-西维来司他钠系统的氢键数也在 0 到 6 之间变化,但在大多数取样构象中,氢键平均数明显高于 5。在 PDGFRB-Sivelestat 复合物中观察到了更明显的变化,氢键从 0 到 8 不等,但主要的相互作用状态保持了大约 4 个氢键。JAK2-JH1-Sivelestat 复合物的氢键范围介于 0-7 之间,在富有成效的结合阶段,氢键的模态值为 4。 均方根波动(RMSF)分析(图 S4E)显示,所有复合物的残基灵活性都很有限,大多数氨基酸残基的波动都低于 3.0 Å。 总之,全面的分子动力学分析证实了西维来司他钠与四个酪氨酸激酶靶标(JAK1、IGF1R、PDGFRB、JAK2)之间稳定的结合构象,其特点是有利的氢键相互作用、受限的结构波动和持续的构象稳定性。这些计算发现有力地支持了西维来司他钠通过强大的分子识别机制成为多靶点抑制剂的潜力。
在本研究中,我们采用网络药理学方法预测并通过实验验证了与西维来司他钠治疗 PAH 相关的潜在生物靶点、功能过程和信号通路。此外,我们还通过实验验证确认了包括IGF1R、JAK1、JAK2和PDGFRB在内的关键生物靶点。我们的研究结果表明,西维来司他钠可通过抑制 PAECs 和 PASMCs 的增殖和迁移以及改善肺血管重塑来缓解 PAH。 根据网络药理学预测,我们确定了六个枢纽基因。然而,目前的研究表明,西维来司他钠在内皮损伤中起着重要作用。因此,我们专门在 PAECs 中进行了验证,发现四个基因发生了变化。我们推测这一结果可能是由于并非所有与 PAH 发生有关的基因都在内皮细胞中发挥作用;它们也可能通过涉及平滑肌细胞、巨噬细胞和成纤维细胞的途径影响 PAH。我们没有进一步探讨这方面的问题,这也是我们研究的局限性之一。 此外,它还通过调节 PI3K/AKT/mTOR 信号通路在疾病的发病机制中发挥作用。我们的实验证实 PAH 患者 PAECs 中 IGF1R 表达上调。值得注意的是,我们发现使用西维来司他钠可抑制 IGF1R 的表达,这表明西维来司他钠通过调节 IGF1R 可用于治疗 PAH。 JAK1 和 JAK2 是细胞内酪氨酸激酶,在 JAK-STAT 信号通路中发挥关键作用,而 JAK-STAT 信号通路对于介导各种细胞反应,包括炎症和免疫功能至关重要。靶向 JAKSTAT 信号通路有望改善 PAH,因为它能改变该病的病理过程。研究发现,抑制 JAK1 和 JAK2 能防止肺血管床纤维化并缓解 PAH。此外,西维来司他钠能显著抑制 JAK1 和 JAK2 的表达,这表明它可能通过调节 JAK-STAT 信号传导而在缓解 PAH 病程进展方面发挥有益作用。 PDGFRB 是一种受体酪氨酸激酶,在调控细胞增殖、存活和血管重塑方面发挥着重要作用。这表明西维来司他钠可能通过与 PDGFRB 信号通路的相互作用对肺动脉高压产生有益影响,可能有助于减少血管重塑和改善预后。 将 IGF1R、JAK1/JAK2 和 PDGFRB 确定为枢纽基因(图 2-3)与它们在 PAH 发病机制中的既定作用(如 IGF1R/PASMC 增殖、42 JAK-STAT 信号在血管重塑中的作用49)相一致。这些靶点的分子对接和实验抑制(图 5-7)验证了它们与西维来司他钠机制的相关性。观察到的 RVSP、血管重塑和 PAEC/PASMC 增殖/迁移的减少(图 4-7)直接支持了西维来司他钠通过靶向缺氧驱动途径改善 PAH 的结论。 本研究将网络药理学与基础实验相结合,深入探讨了西维来司他钠治疗肺动脉高压的可行性,呈现出显著优势。我们首次发现了西维来司他钠作为肺动脉高压的潜在治疗药物,并揭示了其可能的内在机制。虽然本研究发现了西维来司他钠通过IGF1R、JAK1/JAK2和PDGFRB调节缓解缺氧诱导的PAH的潜力,但有几个局限性值得考虑。缺氧模型虽然被广泛使用,但可能无法完全复制与 PAH 相关的中性粒细胞弹性蛋白酶驱动的炎症通路。网络药理学确定了可用药靶点的优先顺序,但排除了典型的 PAH 基因(如 BMPR2),而且样本量小限制了统计能力。虽然网络药理学为确定西维来司他钠在 PAH 中的潜在靶点提供了一个广泛的框架,但这种方法本质上强调的是广度而非深度。该研究优先揭示了多靶点相互作用(如 IGF1R、JAK1/JAK2、PDGFRB),以反映 PAH 的多因素性质,但并未完全阐明上游驱动因素(如转录因子、激酶)或这些靶点之间的分级信号关系。未来的研究应整合多组学数据(如转录组学、磷酸化蛋白组学),以解析机理层次并验证西维来司他钠发挥治疗效果的主要途径。
1. 对象与方法 招募2021年12月至2022年6月期间于河南省胸科医院手术室急诊行手术治疗的AAAD 患者72例,采用随机数字表法将其分为西维来司他钠组(S组)和乌司他丁组(U组) ,每组36例。两组基线资料比较差异无统计学意义(P>0.05)。见表1。由一名未参与患者临床管理的研究者对研究分组、干预和结果进行记录。患者、参与围术期管理的麻醉医师、外科医师和术后护理人员均对分组、干预方法不知情。指标观察者和统计学分析者对分组、干预方法不知情。本研究获河南省胸科医院医学伦理委员会批准[批号: (2021)伦审第(10-04)],研究对象及其家属签署知情同意书。 2. 构建蛋白质-蛋白质相互作用(PPI)网络 在本研究中,我们将交叉基因导入 String 数据库,并使用智人的特定设置进行分析。我们将置信度阈值设定为大于 0.9,并选择隐藏断开的节点,从而生成基因 PPI 网络供进一步分析。 3. 枢纽基因的聚类分析 在对 PPI 数据进行深入分析后,我们利用 Cytoscape 软件中的 MCODE 和 Cytohubba 插件分别生成节点聚类和识别中心节点27,28。MCODE 插件专门用于识别具有相似生物学功能的节点簇,每个簇中得分最高的节点称为 SEED,被视为该特定簇的关键目标。此外,Cytohubba 插件还提供 11 种不同的拓扑分析方法,根据 PPI 网络中节点的特征对其进行排序29 ,目的是识别其中的枢纽基因。为了提高识别结果的可信度,我们采用了多种评估方法,特别是四种算法: 为了提高识别结果的可信度,我们采用了多种评估方法,特别是四种算法:度(直接相互作用的数量)、最大克立中心性(MCC,最大全连接子网络中的节点)、边缘渗透成分(EPC,边缘去除的弹性)和最大邻近成分密度(DMNC,局部网络密度),以确定重要的基因29,30。最终的中心基因: ERBB2、IGF1R、JAK1、JAK2、PDGFRB、PTPN11 在所有四种算法中均排在前 50 位,因此被优先考虑。 4. GO 和 KEGG 通路富集分析 功能富集分析工具 OmicShare 是一个免费的在线数据分析平台,专为进行 GO 和 KEGG 通路富集分析而设计。31 在 GO 分析中,观察到基因在生物过程(BP)、细胞组分(CC)和分子功能(MF)三个类别中显著富集。同时,KEGG 通路分析确定了与研究基因相关的关键信号通路。该分析采用了 q 值调整显著性水平,临界阈值设定为 p < 0.05。 5. 分子对接 首先,我们从蛋白质数据库(PDB)中获取了六个关键基因的三维晶体结构。33 随后,我们从 PubChem 数据库中获取了西维来司他钠的三维结构,34 并使用 OPEN Babel 软件将其格式转换为 PDB 文件。亲和力值小于 6.5 kcal/mol 表示化合物与靶标之间的结合有效。 6. 分子动力学模拟 使用 Gromacs 2022 软件对复合物进行了 100ns 分子动力学模拟(MD)。选择 Charmm 3636 作为蛋白质力场,选择 Gaff2 作为配体力场,选择 TIP3P 水模型为蛋白质-配体系统添加溶剂,并创建一个周期边界为 1.2 nm 的水盒37。然后模拟了 100,000 步等温等体积集合平衡和等温等压集合平衡,耦合常数为 0.1 ps,持续时间为 100 ps。范德华和库仑相互作用均使用 1.0 nm 截断值进行计算。最后,在恒温(310 K)和恒压(1 bar)条件下,使用 Gromacs 2022 对系统进行了模拟,共模拟了 100 ns。 7. 动物实验 在对大鼠实施安乐死之前,我们首先给大鼠腹腔注射 40 mg/kg的戊巴比妥钠进行麻醉。随后,经右侧颈外静脉将预装肝素铜的 PE-50 导管(中国成都泰盟公司)插入右心室。导管的另一端连接到压力传感器(中国成都泰盟),并与多芯生理记录仪相连,以测量右心室收缩压(RVSP,单位:毫米汞柱)。记录的 RVSP 值可间接反映肺动脉内压力的变化。取出心肺组织后,我们将这些标本浸入多聚甲醛中,并进行苏木 精和伊红染色,以评估右心室和肺动脉的重塑情况。然后,我们用公式计算中层壁厚度的百分比(WT%): WT% = 2 ×(WT/外径)×100。 8. 西维来司他钠的剂量表 我们通过动物实验评估了西维来司他钠对 PAH 的治疗效果。通过四周的缺氧暴露建立大鼠肺动脉高压(PAH)模型后,动物再接受西维司他钠给药两周。缺氧大鼠每天腹腔注射西维来司他钠。西维来司他钠的剂量(20 mg/kg/天、50 mg/kg/天和 100 mg/kg/天)是根据先前的研究结果确定的。 9. 缺氧诱导 PAH 大鼠模型的建立 在本研究中,我们使用了6至8周大的雄性Sprague-Dawley(SD)大鼠,所有大鼠均来自锦州医科大学,健康状况良好。大鼠的饲养条件符合标准,食物和水的获取不受限制。所有动物实验和程序均经锦州医科大学研究伦理委员会批准(批准号:2022031001)。经过 7 天的适应期后,研究小组将缺氧模型大鼠置于配备有气体控制输送系统(Oxycycler Model A84XOV;BioSpherix, Ltd., China)的环境中,氧气浓度保持在 10% ± 0.5%。而对照组的雄性大鼠则在正常氧气条件(21% O2)下饲养。为确保实验室内的二氧化碳浓度保持在 3% 以下,实验箱内放置了钠钙来吸收二氧化碳,同时使用变色硅胶来吸收水蒸气。缺氧暴露4周后,我们通过腹腔注射西维来司他钠或生理盐水对大鼠进行治疗。在整个实验过程中,所有大鼠都被饲养在温度为 23°C 至 26°C 的环境中,光暗周期为 12 小时。每周对动物的健康状况和行为进行监测,以确保实验的顺利进行,研究结束前没有大鼠死亡。 10. 运动距离测量 为了评估大鼠的运动能力,测量了它们在跑步机上的最大跑步距离。测试开始时,跑步机带的初始速度设定为 10 米/分钟,每 5 分钟增加 5 米/分钟,直至达到 25 米/分钟的最高速度。然后将这一最高速度保持 15 分钟。试验要么在 30 分钟后结束,要么在大鼠表现出疲劳迹象时结束,疲劳迹象的定义是大鼠在冲击网格上不动超过 5 秒钟。本研究符合动物实验伦理标准。 11. 细胞培养 PAECs (目录号 3100)和 PASMCs(目录号 3110)来自 Sciencell 公司,在专用培养基(目录号 1001、1101)中培养。随后的实验选择了第 3 至第 6 层的细胞。为了进一步研究西维来司他钠治疗 PAH 的潜在机制,将两种细胞类型置于缺氧环境(1% O2)中培养 24 小时。同时,我们评估了西维来司他钠处理对细胞迁移和增殖的影响。西维来司他钠的浓度分别为 50 μmol/L、100 μmol/L 和 200 μmol/L,这些浓度是根据先前的研究结果选定的。 12. 定量 PCR (qPCR) 按照生产商的说明使用 Trizol 试剂(Invitrogen 公司)从肺动脉内皮组织中提取总 RNA。提取后,使用反转录试剂盒(Transgene)将 2 μg 总 RNA 反转录为 cDNA。随后,使用 SYBR Green PCR 混合液(中国贝奥天美)和实时 PCR 仪器(ABI 7500)进行 qPCR 分析。CT 值通过 Applied Biosystems 7500 序列检测系统软件获得,β-肌动蛋白作为内参以确保结果的准确性。所有引物均由 Primerbank 设计,Sangon Biotech(中国上海)合成。 13. Western 印迹 从大鼠肺组织中小心剥离肺动脉后,用镊子切断动脉并刮取内皮组织。用 RIPA 裂解缓冲液和蛋白酶抑制剂的混合物裂解内皮组织。进行双喹啉酸定量后,在 10% SDS-PAGE 凝胶上分离含有 30 µg 蛋白质的样品,然后将其转移到聚偏二氟乙烯(PVDF)膜上。用 5%牛血清白蛋白阻断后,用一抗在 4°C 孵育 PVDF 膜 12 小时,然后用相应物种的二抗孵育 2 小时。加入增强化学发光发光液后,使用化学发光系统对蛋白质条带进行成像。使用 ImageJ 对数据进行定量分析,β-肌动蛋白作为负载对照。相应的一抗如下 胰岛素样生长因子 1 受体(IGF1R,ab182408,1:1000,Abcam)、Erb-b2 受体酪氨酸激酶 2(ERBB2,ab134182,1:1000,Abcam)、Janus 激酶 1(JAK1,ab133666,1:5000,Abcam)、Janus 激酶 2(JAK2,ab108596,1: 血小板衍生生长因子受体 beta(PDGFRB,ab313777,1:1000,Abcam)、蛋白酪氨酸磷酸酶非受体型 11(PTPN11,ab300579,1:1000,Abcam)、肌动蛋白 beta(β-肌动蛋白,ab7817,1:1000,Abcam)。 14. 细胞增殖试验 我们使用 CCK-8 检测试剂盒(K1076l;APExbio,美国)来评估细胞活力。具体来说,将不同组的 PAECs 和 PASMCs 播种到 96 孔板中。培养 6 小时后,将平板置于正常氧气条件或缺氧条件下再培养 24 小时。24 小时培养期结束后,我们在每个孔中加入 10 µL CCK-8 溶液,然后在 37°C 下培养 1.5 小时。随后,使用波长为 450 nm 的微孔板阅读器测量各孔的吸光度。此外,我们还使用了 5-乙炔基-2′-脱氧尿苷(Edu)细胞增殖检测试剂盒(K1076l;APExbio)来评估 PAECs 和平滑肌细胞的增殖情况,并遵守了制造商的说明。在本研究中,这些细胞在常氧和缺氧条件下培养在六孔板中。每孔接种 5 × 10^4 个细胞,每组加入 1 mL Edu 后在 37°C 孵育 3 小时。为了固定细胞,我们加入 4% 多聚甲醛 20 分钟,然后用 0.5 mL 点击反应溶液培养每个孔 30 分钟。为确保实验结果的可靠性,整个实验至少重复四次。最后,我们用 DAPI 对细胞核染色 10 分钟,以方便观察和后续分析。 15. 细胞迁移实验 细胞迁移采用 Transwell 和划痕法进行评估。在划痕试验中,将不同组的细胞以每孔 5 × 10^5 个的密度接种到 6 孔培养板上,培养至达到汇合。然后用干净的 200 μL 移液管吸头在孔表面划出一道线性划痕。然后用 PBS 冲洗细胞三次,加入无血清培养基,在适当条件下培养 24 小时。使用倒置光学显微镜(IX71,日本奥林巴斯公司)测量迁移宽度,并在 0 小时和 24 小时时采集图像。对于 Transwell 试验,按照制造商的说明使用 24 孔板。在此设置中,将 200 μL 不含 FBS 的细胞悬浮液(共含有 10,000 个细胞)放入上腔,同时在下腔加入 600 μL 含 FBS 的培养基(不含细胞)。共孵育 24 小时后,取出上腔,用 4% 多聚甲醛固定细胞。然后用 1%结晶紫溶液对细胞染色 15 分钟,用棉签轻轻擦去膜上表面的非迁移细胞。最后,用光学显微镜拍摄迁移细胞,记录实验结果。 16. 统计分析 使用功率分析法(G*Power 3.1,α = 0.05,功率 = 0.8,效应大小来自试验性实验)事先确定了样本大小,结果是体内研究每组 n = 8 只大鼠(缺氧模型组有 4 只死亡),体外实验 n = 4 个独立生物重复。数据以平均值 ± 标准差 (SD) 表示。正态性用 Shapiro-Wilk 检验进行评估,方差齐性用 Levene 检验进行确认。两组间的比较,对正态分布数据采用非配对双尾学生 t 检验;否则采用非参数 Mann-Whitney U 检验。多组分析对正态分布数据采用单因素方差分析和 Tukey 后校正,对非参数数据集采用 Kruskal-Wallis 和 Dunn 检验。所有分析均使用 GraphPad Prism 9.0(美国 GraphPad 软件公司)进行,统计显著性设定为 P <0.05。实验方案独立重复四次,以确保可重复性。 参考文献: Deng X, Qiu P, Li X, Hu Y, Que Q, Zhang K, Deng T, Liu Y. Potential of Sivelestat for Pulmonary Arterial Hypertension Treatment: Network Pharmacology-Based Target Identification and Mechanistic Exploration. Drug Des Devel Ther. 2025 May 20;19:4123-4138. doi: 10.2147/DDDT.S507240. PMID: 40416794; PMCID: PMC12103203.
|
广告位招租
网站关键词: 武汉都市之窗